第663号 2014(H26) .07-08発行
PDF版はこちら
農業と科学 平成26年7-8月
本号の内容
§土壌の塩基バランスと土壌溶液の塩基バランス
九州大学大学院 農学研究院
和田 信一郎
§下水灰の肥料用原料化技術の開発研究
公益財団法人日本下水道新技術機構資源循環研究部
落 修一
国立大学法人名古屋大学大学院工学研究科
窪田 光宏
国立大学法人岩手大学工学部
伊藤 歩
日本肥料アンモニア協会
成田 義貞
土壌の塩基バランスと土壌溶液の塩基バランス
九州大学大学院 農学研究院
和田 信一郎
1.はじめに
土壌診断の指針として,土地利用や土壌のタイプごとに土壌の改良目標値が設定されている(農林水産省,2012)。可給態養分量に関しては推奨範囲つまり上限と下限が示されている。これは当然のことであり,大部分の植物養分では欠乏症と直接間接の過剰症の両方が懸念されるからである。カリウム(K),カルシウム(Ca),マグネシウム(Mg)(塩基と総称される)の場合,交換態≒可給態であり,交換性塩基の合計保持量は土壌の有効陽イオン交換容量で制限されることから,個々の塩基の含有量を任意に定めることはできない。このため,陽イオン交換容量(CE)に占めるK,Ca,Mgの当量パーセント(当量という用語の使用は推奨されていないがここではこの用語を用いる)と,Ca/Mg比,Mg/K比の推奨値が示されている。土の種類や作物種によって若干異なるものの,野菜畑の場合にはCa/Mg比,Mg/K比はおおよそそれぞれ3~7,2~4程度が推奨されている。
土耕栽培は「土壌溶液を用いた養液栽培」という側面がある。必須養分だけでなく,カドミウムイオンの吸収やアルミニウムイオンの生育阻害効果なども,単位質量あるいは単位体積の土壌における含有量よりも,土壌溶液中の濃度(より正確には活量)によって決まるという実験結果が多く示されている(Wolt,1994)。養液栽培用の培養液には多くの種類があり,栽培対象の作物の種類によって使い分けられている。培養液では,個々の養分の濃度が指定され,濃度比の推奨値が示されることはないが,代表的な培養液組成から計算すると,培養液で採用されているCa/Mg比はおおよそ1.5~3,Mg/K比は0.25~0.7で、あることが多い(いずれも当量濃度比)。表1にまとめて示すように,両者の数値はまったく異なっている。

土耕栽培が土壌溶液を用いた養液栽培であるならば,土壌のCa/Mg比(交換性陽イオンの量比)が3~7のときには土壌溶液のCa/Mg濃度比は1.5~2,土壌のMg/K比が2~4のときに土壌溶液のMg/K当量濃度比は0.25~0.7になっていることが期待される。しかしこれまで,土壌の交換性陽イオンの量比と土壌溶液中の陽イオンの濃度比の関係を論じた報告はほとんどなく,しかも養液組成と関係させながら論じた報告は見当たらない。また,土壌の交換性陽イオン組成と土壌溶液
組成の両方を測定したデータも意外と少ない。そこでここでは,これまでの土壌化学の知見に基づいて,両者の関係を主として計算によって考察したい。
2.交換性陽イオン組成と土壌溶液組成の関係
交換性陽イオンと土壌溶液中の陽イオンとは陽イオン交換反応を通じて相互作用しており,陽イオン交換反応は非常に早い反応であるので,土壌では交換性陽イオンと土壌溶液中の陽イオンの交換反応は常に平衡状態にあるとみなせる。Caと
Mg,MgとKの交換反応は,Xを土壌物質(主として粘土鉱物)の-1の電荷をもつ部分とすれば次式で表すことができる。
CaX2+Mg2⁺=MgX2+Ca2⁺ (1)
MgX2+2K⁺=2KX+Mg2⁺ (2)
これらの反応の進みやすさの尺度として,選択係数という量が用いられ, Ca→Mg交換反応では

で定義される。一方,Mg-K交換反応では

となる。Mg→Kの場合にはMgとKが1:2の比率で交換するため,Kに関する項が2乗されている。
選択係数は平衡定数とは異なり,一般には定数ではなく,イオン交換態の吸着イオン組成によって変化する。ここで採用した選択係数はGaines-Thomasの選択係数とよばれる選択係数である。
3.土壌のCa/Mg比と土壌溶液のCa/Mg比
多くの土壌や粘土鉱物におけるCa→Mg交換反応の選択係数値は約0.7である(Bruggenwert and Kamphorst,1979)。多腐植質黒ボク土のように腐植物質含量の高い土壌ではそれよりやや低く0.5に近くなることもある(Nakahara and Wada,1994)。CaとMgはいずれも2価のイオンであるため(1)式の活量は濃度で置き換えることができる。そのため,(1)式は

と変形できる。この式の右辺はCa/Mg比そのものである。この式と,土壌や粘土鉱物のCa→Mg交換反応の選択係数の値が0.5~0.7であることを考慮すると,土壌溶液のCa/Mg比は土壌のCa/Mgの0.5~0.7倍であることになる。
図1はこの関係を示す。図の網掛け部分が,土壌のCa/Mg比に対応して定まる土壌溶液のCa/Mg比の範囲である。また,水平の点線は,培養液で採用されているCa/Mg比の範囲を示す。土壌のCa/Mg比が6以上であれば,土壌溶液のCa/Mg比は土壌の種類を問わず溶液で推奨されているCa/Mg比を上回る。しかし土壌のCa/Mg比が4以下であれば,土壌溶液のCa/Mg比は溶液で推奨されている比の範囲内にほぼ収まる。
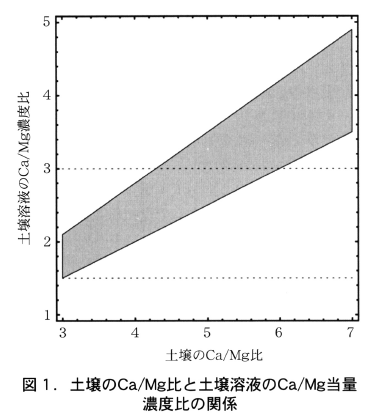
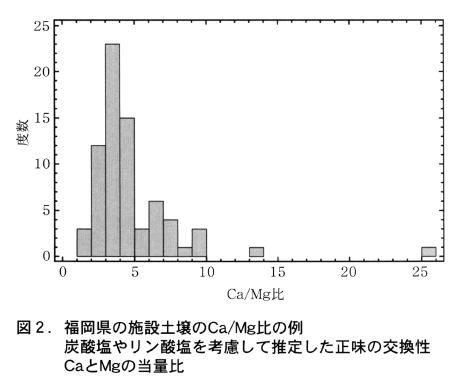
図2は福岡県の施設土壌73点について,遊離炭酸カルシウムやリン酸カルシウム(その一部は交換性陽イオン測定時に酢酸アンモニウムに溶解する)の存在を考慮して推定した正味の交換性CaとMgの当量比の度数分布である。大部分の施設土壌では,Ca/Mg比は3~5となっており,図1から,それに対応する土壌溶液のCa/Mg濃度比はほぼ1.5~3の範囲に収まっていることが予想される。土壌のCa/Mg比が培養液で採用されているCa/Mg濃度比よりも高く設定されているのは,土壌がMgよりもCaをやや選択的に吸着するためであると理解できる。そして,土壌のCa/Mg比が土壌診断における推奨値の範囲にあればその土壌の土壌溶液のCa/Mg当量濃度比は養液栽培の培養液で採用されているCa/Mg濃度比の範囲にほぼ納まることになる。
4.土壌のMg/K比と土壌溶液のMg/K比
Mg/K比についてもCa/Mg比で行ったのと同じ考察をすることができる。しかしこの考察には,Ca/Mg比に関する議論の場合よりも難しい点が2つある。第1は土壌のMg→K交換反応に関する実験データが非常に少ないこと。第2は,Mg→K交換反応の化学量論は1:2であるので,選択係数の定義式においてKのモル分率や活量が2乗されているため,交換体のMg/K比と土壌溶液のMg/K比が1:1で対応しないということである。
第一の問題は,Mg→K交換反応の選択係数を次式によって,Ca→Mg交換反応の選択係数とCa→K交換反応の選択係数から計算することによって解決できる。
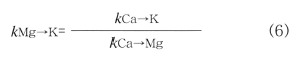
この式に,Ca→Mg交換反応およびCa→K交換反応(たとえば Wada and Odahara,1993)の平均的な選択係数値を代入すると,Mg→K交換反応の選択係数は,K飽和度が4~6%の場合,11~80の範囲にあると推定される。
第二の問題は,Mg→K交換反応の化学量論が1:2であるため,土壌のMg/K比が決まっても土壌溶液のMg/K濃度比は決まらないということであった。(2)式からわかるように1:1に対応するのは(吸着Mgの当量分率)/(吸着Kの当量分率)2と(土壌溶液のMg活量)/(土壌溶液のKの活量)2なのである。(2)式を少し変形し,活量≒濃度とすると,
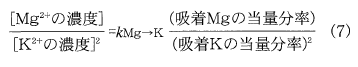
という関係が得られる。右辺に選択係数の値と,交換性Mgおよび、Kの当量分率を代入すると(Mg2⁺の濃度)/(K+の濃度)2が求まるがMg/K当量濃度比は一義的には決まらない。
いま,活量≒濃度とし,(7)式をまた少し変形すると,

という関係が得られる。この式に,選択係数の値と,吸着イオンの当量分率および土壌溶液のK濃度を代入するとその条件に対応するMg濃度を計算することができる。ここで吸着MgおよびKの当量分率を0.12および0.06(Mg飽和度12%,K飽和度6%に相当),Mg→K交換反応の選択係数を30とし,K濃度としていくつかの値を入力してMg濃度を計算して表2に示した。またMg濃度およびK濃度からMg/K当量濃度比を計算して同じ表に示した。表2からわかるように,土壌のMg/K比が一定であっても,その土壌と陽イオン交換平衡にある土壌溶液のMg/K濃度比は土壌溶液の塩濃度によって異なる値をとる。一般的な傾向としては,塩濃度が上昇するとMg/K比も高くなる。

表2に示した計算例では,MgとKの2つのイオンしか考慮していない。そこでもっと現実的にすべく,Ca,Mg,Kの2種の陽イオンを考慮し次のような条件下で陽イオン交換平衡の計算を行った。
1)土壌のCa飽和度は82%,Mg飽和度は12%,K飽和度は6%
2)土壌のCa→K交換反応の選択係数の対数値は2,3,4の何れか
3)土壌のCa→Mg交換反応の選択係数は0.7
4)土壌のMg→K交換反応の選択係数は2),3)から計算
5)土壌溶液の陰イオンはすべて硝酸イオン
6)ナトリウムイオンは無視できるほど少ない
以上の条件で陽イオン交換平衡の計算を行って,条件1)に示す交換性陽イオン組成に対応する土壌溶液組成を求め,それから土壌溶液のMg/K当量濃度比を計算し,土壌溶液の硝酸イオン濃度に対してプロットしたのが図3である。
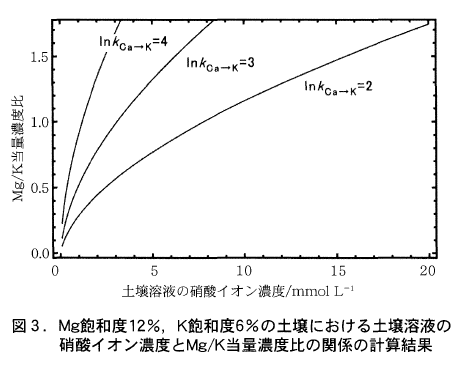
この計算における土壌のCa/Mg比は,82/12=6.8,Mg/K比は12/6=2であるので,土壌診断における推奨範囲内ではあるが,Mg飽和度がやや低めにとられている。この条件下での土壌溶液のMg/K当量濃度比は土壌溶液の塩濃度(この計算では硝酸イオン濃度)と土壌のカリウム選択性に依存する。Ca→K交換反応の選択係数の対数値が2の場合,土壌溶液の硝酸イオン濃度(=Ca,Mg,Kイオンの当量濃度の合計)が約8mmol/LまでならMg/K当量濃度比は1以下に保たれる。土壌のKに対する選択性が高く,選択係数の対数値が4の場合には土壌溶液のMg/K当量濃度比が1以下に保たれるのは土壌溶液の硝酸イオン濃度が1mmol/L以下の場合に限られる。
以上の計算例から,土壌のK選択性があまり高くなく,土壌溶液の塩濃度が低い場合には,土壌のMg/K比を土壌診断における推奨値の範囲に調節すれば,土壌溶液のMg/K濃度比は養液栽培用培養液で採用されている値に近くなる可能性があることがわかる。また,バルクの土壌溶液の塩濃度が高い場合にも,根圏土壌の土壌溶液の塩濃度はそれよりも低くなることがあると考えられるので(岡島・松中,1973),Mg/K当量濃度比もバルクの土壌溶液のものよりも低く保たれる可能性もある。しかし一般論としては,土壌溶液のMg/K当量濃度比が培養液で採用されている値の範囲に収まるのは,土壌のMg/K比がかなり低く,土壌のK選択性も低く,さらに土壌溶液の塩濃度が低い場合に限られると考えた方がよさそうである。つまり,陽イオン交換平衡の観点からは,土壌の交換性陽イオン組成が土壌診断基準を満たしている場合でも,土壌溶液のMg/K当量濃度比は養液栽培の培養液で採用されているMg/K当量濃度比の範囲を超えて大きい場合が相当ある,あるいはそのような例の方が多いとさえ予想される。
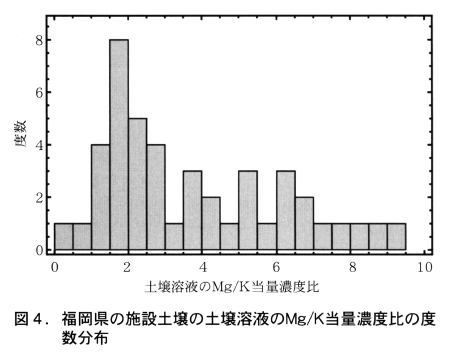
実際,土壌溶液のMg/K当量濃度比の測定値は養液栽培の培養液で採用されているものよりも高いことが多い。図4は福岡県下の施設土壌で,土壌のCa/Mg比および、Mg/K比が土壌診断基準を満足しているものから採取した土壌溶液のMg/K当量濃度比のヒストグラムである。Mg/K当量濃度比が1以下のものは少なく,1~3のものの頻度が高く,それ以上のものも相当数ある。この分析は跡地土壌について行ったものであるので,栽培期間中の土壌溶液のMg/K当量濃度比はこれよりも低かった可能性もあるが,大部分が養液栽培の培養液で採用されている0.25~0.7に収まるとは思えない。
これらの土壌に10aあたりK2Oとして30kg相当のカリウム肥料を施用し,含水比25%,乾燥密度1.0kg/Lの作土15cmに混合すると,Kの添加量は約0.4cmolc/kgとなる。添加されたKが全て交換性Kとして吸着されるなら,CECが10cmolc/kgの土壌ではK飽和度が4%上昇,CECが20cmolc/kgの土壌でも2%上昇することになる。つまり,Ca/Mg比やMg/K比が推奨範囲にある土壌にK肥料を施肥した場合には,土壌溶液のMg/K当量濃度比は当然のことながらある程度低下する。しかし施肥した場合には土壌溶液の塩濃度も上昇するので,Mg/K当量濃度比の上昇効果は限定的である。紙数の都合で詳細な結果は示さないが,このような仮定で計算しても,土壌溶液組成は培養液で採用されているような組成にはなりにくかった。
結局,土壌のMg/K比を2~4としても,土壌溶液のMg/K当量濃度比は養液栽培の培養液で採用されている0.25~0.7の範囲には収まらず,それ以上の値となることが多いのではないかと予想される。このことは,多くの土壌においては,土壌のK飽和度を相当高くしても土壌溶液のMg/K比は養液栽培の培養液のMg/K当量濃度比を下回るようなことは起こりにくいことを意味する。しかしこれは,多くの施設土壌でK過剰によるCaやMgの欠乏が原因と考えられる生理障害が発生していることとはしっくりと来ない。
Mg/K比の不整合ということだけからの結論は短絡的すぎるのかもしれない。しかし,土耕栽培≒土壌溶液を用いた養液栽培というような単純な見方を再考する余地があるかもしれない。また,カリウムの関与する陽イオン交換反応のパラメーターが正しく評価されているのか,さらに交換性カリウムという量の意味などについても再考する必要があるのではないかと思える。
引用文献
●Bruggenwert,M. G. M and Kamphorst,A. (1979)
Survey of experimental information on cation exchange in soil systems. In Bolt G. H. (ed.)Soil Chemistry B,p. 141-203,Elsevier,Amsterdam.
●Nakahara,O. and Wada,S. -I(1994)
Ca2+and Mg2+adsorption by allophanic and humic Andisol. Geoderma. 61,203-212.
●農林水産省(2012)
都道府県施肥基準等.
http://www.maff.go.jp/j/ seisan/kankyo/hozen_type/h_sehi_kizyun/
●岡島秀夫.松中照夫(1973)
根圏土壌に関する研究 第1報 トウモロコシ,アルファルファ根圏土壌の無機成分について.
土肥誌,44,413-420.
●Wada,S.-1. and Odahara,K.(1993)
Potassium-calcium exchange in five Ap soils from paddy fields and its effect on potassium concentration in soil solution. Soil Sci. Plant Nutr. 39,129-138.
●Wolt,J. (1994) Soil Solution Chemistry. John
Wiley &Sons,N ewY ork.
下水灰の肥料用原料化技術の開発研究
公益財団法人日本下水道新技術機構資源循環研究部
落 修一
国立大学法人名古屋大学大学院工学研究科
窪田 光宏
国立大学法人岩手大学工学部
伊藤 歩
日本肥料アンモニア協会
成田 義貞
1.はじめに
昨今の国際的な肥料および肥料原料の高騰は我が国の農業に大きな影響を及ぼしている。その中で,下水道には国民の生活を通じてリン等の肥料資源が効果的に集積され,下水の処理過程から発生する汚泥,中でもそれを焼却した灰にはリン鉱石に匹敵するリン酸を含有していることから,その資源化・利用の重要性が認識されている。しかし,現在のリン酸肥料はリン鉱石からリン酸を抽出・精製して製造される化学プラントとなっており,下水の灰は,組成がリン鉱石とは異なることから直ちに代替資源に成り得ない。また,下水汚泥には重金属が含まれるという風評も消えておらず,円滑な利用には大きな支障となっている。このために,量的にも含有量的にも安定資源として価値が高い下水の灰について,農林水産省の研究開発事業により2011年度から3カ年をもって本開発研究「下水灰の肥料用原料化技術の開発研究」を行ったものである。ここでは,下水灰中に微量に存在する重金属の除去技術やリン酸液としての抽出回収技術の開発に取り組んだ成果の概要を報告する。
2.背景と目的
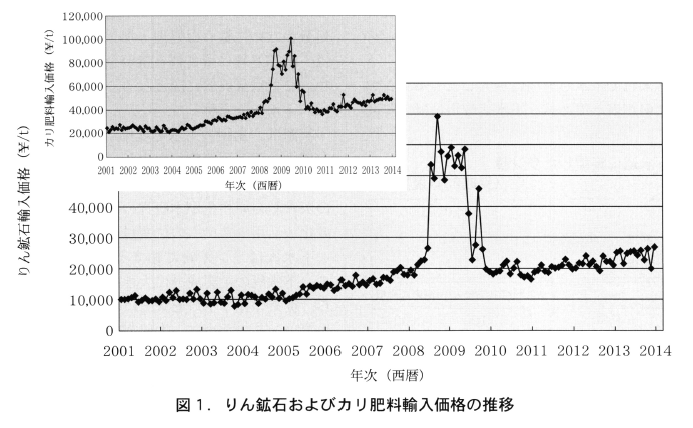
我が国は,リンとカリの全量を輸入に依存している。財務省貿易統計に基づくリン鉱石の輸入価格とカリ肥料の輸入価格の推移を図1に示す。従前はリン鉱石が10,000円/トン,カリ肥料が23,000円/トンほどに安定した推移をみせていたものが,2005年から徐々に上昇し始め,2008年3月に暴騰が起こった。この暴騰は約1年間で落ち着いたものの,その後の輸入価格には安定した上昇傾向が見られる。
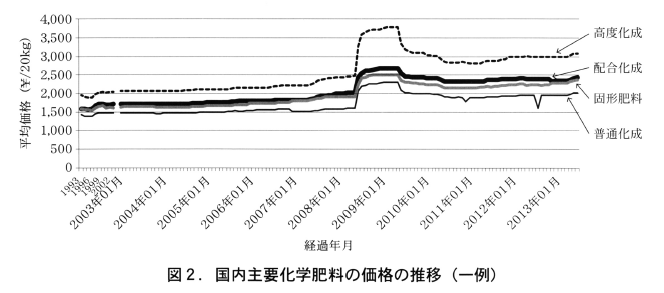
農林水産省農業物価統計調査に基づいた圏内における主要化学肥料の価格の推移の一例を図2に示す。国内における主要な化学肥料の価格も前述の輸入肥料や原料の推移に合わせるように上昇しており,圏内価格は国際情勢に大きく左右されている。
我が国の平成23年度末時点における下水道の人口普及は93,547,831人,人口普及率で75.8%に達している。そこからは年間に約145億㎥の下水が発生・収集され,浄化処理されている。下水中に含まれて下水処理場に流入してくるリンの量を見たのが表1である。下水処理場には,年間5万9千トンほどのリンが集まり,その内の4万3千トンが汚泥中に回収されている。この汚泥中のリンが本研究で扱う資源であり,例えば,これを輸入している高品質リン鉱石の量に換算すると,約33万トンとなる。
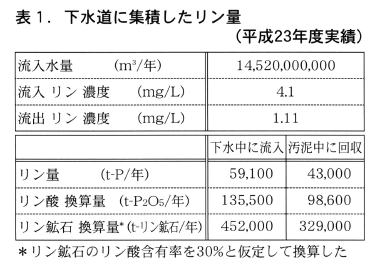
ここで言う汚泥とは,下水を浄化処理する過程で発生する有機物や栄養素に富んだ物質で,大部分が生物由来の物質である。これを我が国では下水汚泥(bio-solids)と称している。
下水汚泥は,下水道の普及人口に比例して発生しているものであり,その汚泥は安定化や利用,処分のために様々な処理・加工がなされる。近年は,焼却処理に資される量が全体の70%近くを占め, これは最終的に灰となる。この灰を本研究では”下水灰”と称している。
実際は,全国の下水処理場から約230万トンの有機性の汚泥固形物が発生し,そこから焼却処理により約23万トンの下水灰が発生している。この灰の肥料原料化が本研究の課題であり,その資源化・活用システムの位置付けを図3に示す。
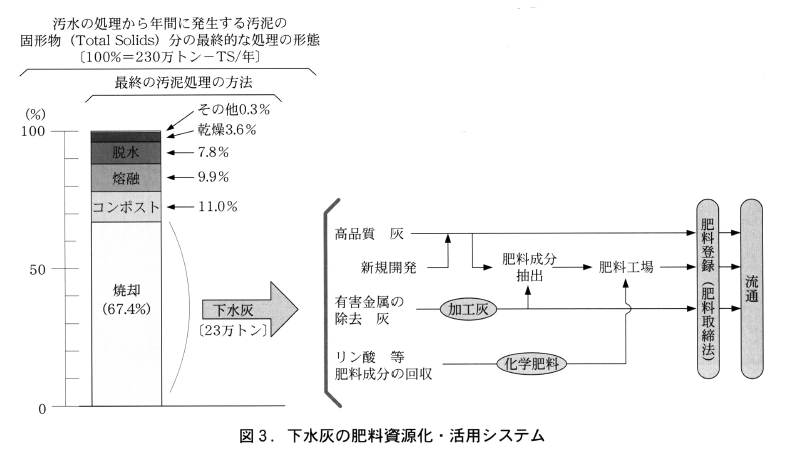
下水灰はリン鉱石に類するリン酸を含むものの,下水灰の主要成分に大きな違いがあることから,従来の化学プロセスではリン肥料までには行かない。このために,本研究では下水灰から肥料成分であるリン酸を効果的に分離・精製する方法の開発を目的とした。また,下水汚泥はその利用に際して重金属の含有が問題視されてきた。それは含有量の如何に拘わらず不評の要因となっており, 相当に利用が制限されてきた。そこで,下水灰の利用者にとってより安心して取り扱える条件を整えるために,極微量に含まれる重金属の分離・除去法の開発がもう一つの目的であった。
3.塩化揮発法による微量重金属の分離・除去
塩化揮発法は,光和精鉱株式会社において昭和36年2月の会社設立当初より,硫酸焼鉱(酸化鉄粉)を原料として高炉用ペレットを製造し,併せて焼鉱中に含まれる有価金属を回収する目的で,会社独自の技術として開発,実用化されてきたものである。本研究においては,同じ原理を応用して下水灰中に含まれる重金属類の酸化物を塩化剤で塩化物化することにより揮発除去を目指すものである。下水灰に対する本法作用のイメージを図4に示す。
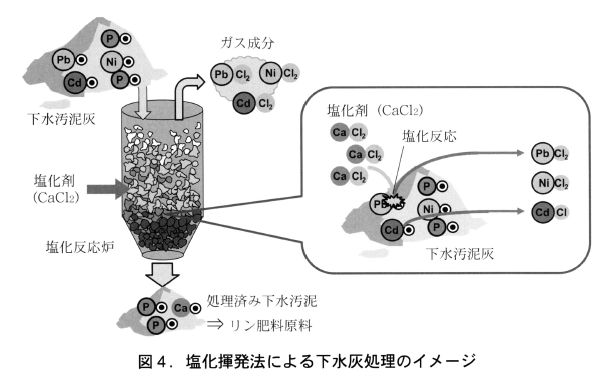
研究では,微量重金属の揮発・分離の基礎的現象を知るための各種の実験を図5に示す実験装置を用いて行った。
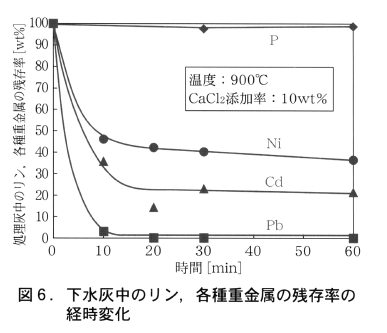
重金属化合物の塩化揮発速度の定式化を目標に,加熱温度(700~900℃),塩化カルシウム添加量(0~10wt%),加熱雰囲気(乾燥空気)を変化させた揮発実験を行い,特に揮発初期における各重金属の揮発率の経時変化についてのデータ収集を行った。研究成果の一例として,温度900℃,塩化カルシウム添加量10wt%での揮発実験を行った際のP,Pb,Ni,Cdの揮発率の経時変化を図6に示す。いずれの重金属類も高い揮発速度を有しており,とくに鉛は加熱開始10分以内に全量が揮発している。また,ニッケル,カドミウムも20分以内に一定値に達しており,ニッケルは50%,カドミウムは20%の残存率まで低減が可能であった。一方,リンは本実験条件での揮発は確認されず,下水灰から重金属のみを揮発させた安全なリン肥料の製造可能性が示された。

4.下水灰からのリン酸の回収
研究は,湿式法による下水灰中のリンと重金属類の分離システムを開発するために,図7に示すとおり,酸により下水灰中のリンと重金属類を溶出した後,そのリンと重金属類を分離するためのシステムを開発することにある。特に研究では,下水灰中に多量に存在するアルミニウムの分離・排除が大きな課題であった。
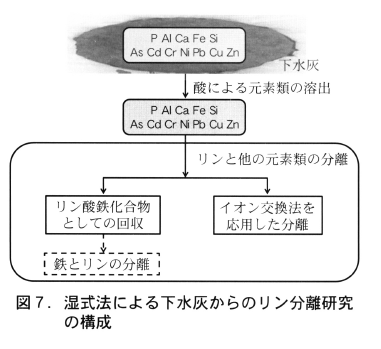
(1)リン酸鉄塩による回収
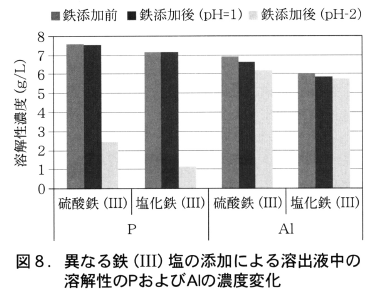
第二鉄イオンの添加とpHの調整により溶出液中のリンをリン酸鉄化合物に変換し,溶出液に共存するアルミニウムや他の重金属類とリンを分離する方法の最適操作条件を明らかにする実験を行った。図8に示すように,硫酸あるいは塩酸を用いた下水灰からの元素類を含むpH=1の溶出液に硫酸第二鉄あるいは塩化第二鉄を添加し,溶出液のpHを2に上昇させることにより,溶解性のリン濃度は顕著に減少するが共存する溶解性Alの濃度は変化しなかった。この結果から,溶出液中のリンをリン酸鉄化合物として沈殿でき,共存する他の重金属類(ヒ素とクロムを除く)と分離できることが分かった。
遠心分離による沈殿物の沈降性について検討した結果,硫酸第二鉄を添加した場合は沈殿物の良好な沈降が観察されたが,塩化第二鉄を添加した場合では水酸化鉄と考えられる懸濁物が生成され,良好な沈降性は得られなかった。
(2)リン酸液の回収
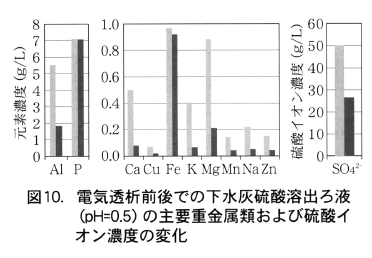
イオン交換膜とチタン・白金電極を用いた電気透析法による溶出液中アルミニウムとリンの分離手法について,図9に示す耐酸性のイオン交換膜を利用した電気透析装置を試作した実験を行い,図10に示すとおり下水灰の硫酸溶出ろ液から鉄以外の重金属類を除去できるリンと重金属類の分離手法を開発した。

本法は,イオン回収槽と電極槽の双方の溶媒としてpH=0.5の希硫酸を用いるとともに,中間槽の溶出液のpHも0.5に調整することにより中間槽のリン濃度を維持しながらアルミニウム濃度を低減するものである。
本法から得られたリン酸液試料を肥料専門家による「燐安」化を行い,公的機関による品質試験に供した結果,良好な品質であるとの評価を得た。
5.むすび
下水灰の肥料資源としての重要性に気付き, これまでも多くの研究,技術開発が試みられてきているが,それが有効として普及しているものはない。その原因に下水灰の資源的価値への意識の違いもあると思われるが,技術的にも大きな問題があったと思われる。一つは,下水灰中に微量に含まれる重金属類の分離除去である。本研究では塩化揮発法という日本の企業で生まれた技術を持ってこれに取り組んだ。技術的問題のもう一つは,有効なリン回収技術が見出せなかったことである。全量を輸入に依存する我が国にあって, この技術の確立は大きな意味を持つ。本研究では試行錯誤を繰り返しながらそれが可能であることを示した。双方の技術とも3年間という研究期間で実用化までには届かなかったが,塩化揮発法はパイロットプラント実験等により実証する段階にきている。リン酸液の回収技術はプロセス化に必要な個々のパーツの性能を定める研究が待っている段階である。今後とも双方の技術の実現に向けて取り組んでいく所存である。関係各位の協力,支援をお願いするものである。
なお,本報文は「”下水灰の肥料用原料化技術の開発研究”報告書,2014年3月,公益財団法人日本下水道新技術機構 他8者」から二つの課題部分の要点を抜粋,報告した。
【謝辞】
本研究は,農林水産省農林水産技術会議「農林水産業・食品産業科学技術研究推進事業」により2011年から2013年度までの3カ年をもって実施されたものである。本研究には名古屋大学,岩手大学をはじめ東京農業大学,独立行政法人農業環境技術研究所,独立行政法人土木研究所,月島機械株式会社,株式会社神鋼環境ソリューション,日本肥料アンモニア協会,公益財団法人日本下水道新技術機構の参画があった。また,研究には愛知県,名古屋市,岐阜市の協力を得た。ここに記して関係機関並びに関係された方々に感謝の意を表します。

